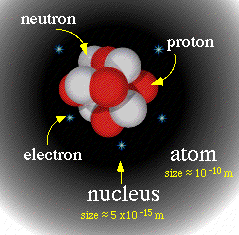
 Um átomo é constituido de um núcleo extremamente pequeno, carregado positivamente, rodeado por uma núvem de elétrons carregados negativamente. Embora tipicamente o núcleo seja menos de dez mil vezes menor que o átomo, o núcleo contém mais de 99.9% da massa do átomo! Os núcleos são constituidos de partículas carregadas positivamente chamadas prótons de outras eletricamente neutras, chamadas nêutrons. Essas partículas são mantidas agrupadas por uma força chamada força forte ou força nuclear. Esta força é muito maior que as forças familiares como a elestrostática que mantém os elétrons ligados aos núcleos, mas tem alcance limitado a pequenas distâncias, da ordem do tamanho do próton ou nêutron (cerca de 10-15 metros).
Um átomo é constituido de um núcleo extremamente pequeno, carregado positivamente, rodeado por uma núvem de elétrons carregados negativamente. Embora tipicamente o núcleo seja menos de dez mil vezes menor que o átomo, o núcleo contém mais de 99.9% da massa do átomo! Os núcleos são constituidos de partículas carregadas positivamente chamadas prótons de outras eletricamente neutras, chamadas nêutrons. Essas partículas são mantidas agrupadas por uma força chamada força forte ou força nuclear. Esta força é muito maior que as forças familiares como a elestrostática que mantém os elétrons ligados aos núcleos, mas tem alcance limitado a pequenas distâncias, da ordem do tamanho do próton ou nêutron (cerca de 10-15 metros).
 O número de protons no núcleo, Z é chamado número atômico. Este número determina o elemento químico do átomo. O número de nêutrons no núcleo é denominado N. O número de massa do núcleo, A, é igual a Z+N. Um dado elemento químico pode ter vários isótopos, que diferem uns dos outros pelo número de nêutrons contidos no núcleo. Num átomo nêutro, o número de elétrons orbitando o núcleo é igual ao número de prótons no núcleo. Como a carga elétrica do próton e do elétron são +1 e -1 respectivamente (em unidades da carga do elétron), a carga total do átomo é zero. Presentemente são conhecidos 112 elementos, desde o mais leve, o hidrogênio até o recentemente descoberto e ainda sem nome,elemento 112. Todos os elementos mais pesados que o urânio foram produzidos artificialmente pelo homem. Entre esses elementos, há cerca de 270 isótopos estáveis e mais de 2000 instáveis.
O número de protons no núcleo, Z é chamado número atômico. Este número determina o elemento químico do átomo. O número de nêutrons no núcleo é denominado N. O número de massa do núcleo, A, é igual a Z+N. Um dado elemento químico pode ter vários isótopos, que diferem uns dos outros pelo número de nêutrons contidos no núcleo. Num átomo nêutro, o número de elétrons orbitando o núcleo é igual ao número de prótons no núcleo. Como a carga elétrica do próton e do elétron são +1 e -1 respectivamente (em unidades da carga do elétron), a carga total do átomo é zero. Presentemente são conhecidos 112 elementos, desde o mais leve, o hidrogênio até o recentemente descoberto e ainda sem nome,elemento 112. Todos os elementos mais pesados que o urânio foram produzidos artificialmente pelo homem. Entre esses elementos, há cerca de 270 isótopos estáveis e mais de 2000 instáveis.
Texto Original: ABC of Nuclear Science (Lawrence Berkeley Laboratory)

