Da Assessoria de Comunicação do Instituto de Física da USP:

Biophysical studies suggest a new structural arrangement of crotoxin and provide insights into its toxic mechanism
Revista NATURE – Scientific Reports
Pesquisa publicada on line em 03 de março de 2017.
http://www.nature.com/articles/srep43885
Uma pesquisa publicada no início deste mês na revista Scientific Reports, da Nature, por um grupo de pesquisadores brasileiros, forneceu um modelo estrutural detalhado da Crotoxina (CTX), uma neurotoxina encontrada em venenos de cobras cascavéis, favorecendo potenciais aplicações terapêuticas desta proteína, como: imunomoduladores, anti-inflamatórias, analgésicas, antitumorais, entre outras.
“Mecanismo de toxicidade da crotoxina revelado por estudos biofísicos”
A crotoxina (CTX) é uma neurotoxina encontrada em venenos de cobras cascavéis (Crotalus durissus terrificus). Este complexo proteico é um heterodímero composto de uma proteína não-tóxica e não enzimática (CA) e outra proteína fosfolipase com características tóxicas (CB). Essa neurotoxina tem diversas potenciais aplicações devido a sua ação paralisante semelhante a toxina butolínica (popular BotoxTM), sendo proposta como medicamento para tratamento do estrabismo devido a seus efeitos serem mais duradouros do que a toxina butolínica. Além disso, aplicações como potencial agente terapêutico, anti-inflamatório e anti-tumoral também são propostas.
Em um artigo recente publicado na revista Nature Scientific Reports (Scientific Reports 7, Article number: 43885 (2017)), pesquisadores da UNESP, USP, UFMG e FUNED obtiveram informações sobre o mecanismo de ação da CTX, indicando quais regiões desta proteína estão envolvidas com a toxicidade. Neste trabalho a combinação de técnicas de calorimetria de titulação isotérmica (ITC), espectroscopia de fluorescência (FE), dicroísmo circular (CD), espalhamento de luz dinâmico (DLS) e espalhamento de raios X a baixos ângulos (SAXS) permitiram a obtenção de um modelo estrutural para a CTX indicando que os triptofanos da proteína estão localizados na interface entre os domínios CA/CB enquanto a região N-terminal do domínio CB é exposta ao solvente.
Este estudo contou com participação do Prof. Cristiano Luis Pinto de Oliveira e de sua ex-aluna de mestrado, Ranata Naporano Bicev, do Departamento de Física Experimental, do Instituto de Física da USP. O Prof. Oliveira foi o responsável pelo planejamento dos experimentos de SAXS que foram realizados no equipamento de Laboratório, NANOSTARTM, presente no IFUSP; analise e modelagem avançada dos dados de espalhamento. Através desta modelagem, combinando o ajuste dos dados de SAXS, estruturas atômicas de alta resolução disponíveis para as proteínas CA e CB e informações provenientes de fluorescência, foi possível obter um modelo estrutural para a estrutura do complexo em solução. Com base nesta estrutura, importantes conclusões sobre o mecanismo de ação da proteína puderam ser obtidas.
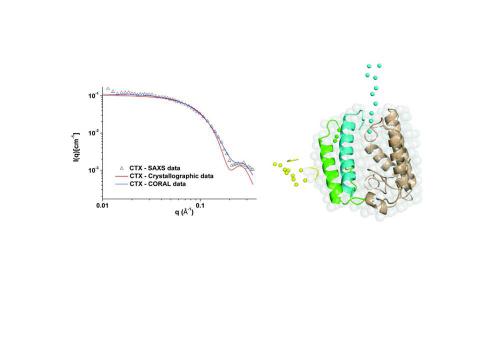
As informações detalhadas das estruturas terciárias e quaternárias da CTX são essenciais para a compreensão dos efeitos imuno-modulatório, anti-inflamatório e analgésicos da CTX. Além disso, esse complexo proteico possui ações anti-tumorais bem como pode inibir o crescimento de tumores, toxicidade contra células tumorais e indução de apoptose e informações estruturais que são muito importantes para o design de novos agentes terapêuticos.
Contato :
Departamento de Física Experimental do Instituto de Física da USP
Prof. Cristiano Luis Pinto de Oliveira
E-mail: crislpo@if.usp.br
Telefone: (011) 3091-7164
Referencia:
Fernandes, C. A. H.; Pazin, W. M.; Dreyer, T. R.; Bicev, R. N.; Cavalcante, W. L. G.; Fortes-Dias, C. L.; Ito, A. S.; Oliveira, C. L. P.; Fernandez, R. M.; Fontes, M. R. M., Biophysical studies suggest a new structural arrangement of crotoxin and provide insights into its toxic mechanism. Scientific Reports 2017, 7, 43885.

